南昌县莲塘一中 罗孟军
一、说教材
•教材的地位和作用
•本节是学生认识离子反应和离子方程式的起始课。
•从教材的体系看,它是初中学习溶液导电性实验、酸碱盐电离知识的延续和深化,又是学习电解质溶液理论知识的基础,所以从体系看起承上启下的作用。
•从研究方法看,它是研究化学反应分类方法的补充以及从本质分析化学反应的必备技能,是中学生现在及至以后学习化学、从事化学专业的知识和能力的重点。
• 本节的知识顺序是:电解质、强弱电解质的概念, 强电解质的电离方程式 , 离子反应, 离子方程式的正确书写。
二、说目标
• 1.认知目标
• ①了解电解质和非电解质的概念;
• ②了解强、弱电解质的概念;
• ③了解离子反应和离子方程式的含义;
• ④了解离子反应发生的条件和离子方程式的正确书写。
• 2 .技能目标
• 通过实验,培养学生观察、分析能力;掌握推理、归纳、演绎和类比等科学方法。
• 3.德育目标
• 运用教材(如强电解质在水溶液里全部电离,但电解质的强弱不以溶液导电能力大小划分;导电能力弱的溶液不一定是弱电解质溶液)对学生适时地进行辩证唯物主义教育,以及普遍性与特殊性的教育。
三、说重点、难点
• 本课时的重点是对强、弱电解质的理解和弱电解质的电离平衡的理解及有关概念、理论和应用。
• 强电解质和弱电解质不是物质本质上的分类。决定电解质强弱的因素复杂,教材仅仅是从电离程度不同加以区分。因此,对强电解质、弱电解质概念的理解、掌握是本节的难点。
为突出重点、难点,在教学中应采取的措施有:
• ①充分利用演示实验的效果,强化对学习重点的感性认识,让学生通过对实验现象的观察分析,得出结论。
• ②充分利用学生已有的知识进行分析对比,在不断辨别中加深对重、难点知识的探究。
• ③通过列表类比和设计重、难点习题等,达到训练思维、提高分析问题、解决问题的能力。
四、说教法
• 本节课主要采用问题探究法,即以问题为切入口,追踪变化的本质,解释疑惑。它有利于培养学生发现问题、提出问题、探究问题的能力。采用这种方法意在渗透探究问题的方法,为学生开展探究性学习创造必要的条件。限于新高一学生的能力,本节课主要以启发性教学、计算机辅助教学为手段,充分调动学生的多种感官。
教学程序:创设情境 → 提出问题 → 引导探究 → 实验研究 →引导分析 → 引导归纳 → 巩固练习
学习程序:明确问题 → 实验研究 → 分析现象 → 形成概念 → 理解应用
教学过程
[提问]同学们在家自己想办法确定下列物质中哪些能导电?思考为什么能导电?
NaCl固体、NaCl溶液、蔗糖固体、蔗糖溶液、酒精溶液、食醋、铁丝、铜丝。
[演示]HCl气体、HCl水溶液(盐酸)导电性
[小结]①铁丝、铜丝能导电,因为其中有自由移动的电子存在。
②盐酸、食醋、NaCl溶液能导电,因为它们的溶液中有自由移动的离子存在。
[追问]在盐酸、食醋、NaCl溶液溶液里的自由移动的离子是怎样产生的?可通过什么方法证明溶液中存在离子?
[小结]①电离产生,其过程可用电离方程式来表示。
②可通过溶液导电性来检验。
[演示] NaCl固体在水中的溶解和电离过程(fiash模拟)
一、电解质和非电解质
• 电解质:在水溶液里或熔化状态下能够导电的化合物,如酸、碱、盐等。
•非电解质:在水溶液里和熔化状态下都不导电的化合物,如蔗糖、酒精等。
[讲解]电解质、非电解质是根据物质在一定条件下能否导电对化合物的一种分类。
• [讨论]下列物质中哪些是电解质?
• Cu、NaCl固体、NaOH固体、K2SO4溶液、SO2、蔗糖、NaCl溶液、H2O、酒精。
• [小结]应注意以下几点:
• ①电解质应是化合物。而Cu则是单质,K2SO4溶液与NaCl溶液都是混合物。
• ②电解质应是一定条件下本身电离而导电的化合物。而SO2能导电是因SO2与H2O反应生成了H2SO3, H2SO3能够电离而非SO2本身电离。所以SO2不是电解质。
[电解质定义可改为]: 在水溶液里或熔化状态下能够(直接电离)导电的化合物

[设问]相同条件下,不同种类的酸、碱、盐溶液的导电能力是
否相同?
(类比相同条件下,不同金属导电能力不同.)
• [演示实验1—1]观察:五种电解质溶液的导电性是否相同?并分析结果。
[结果]:相同条件下,不同种类的酸、碱、盐溶液的导电能力不相同
[讲述]电解质溶液导电能力的大小决定于
• 溶液中自由移动的离子的浓度和离子所带电荷数
• 溶液的温度
• 当溶液体积、浓度、温度和离子所带的电荷数都相同的情况下,取决于溶液中自由移动离子数目,导电能力强的溶液里的自由移动的离子数目一定比导电能力弱的溶液里的自由移动的离子数目多。
二 电解质分类:强电解质和弱电解质
• 1.强电解质:在水溶液中全部电离成离子的电解质。如NaCl、NaOH等(写出电离方程式)
• 2.弱电解质:在水溶液中只一部分电离成离子的电解质。如NH3·H2O、CH3COOH等
[归纳]强、弱电解质的比较
|
|
强电解质 |
弱电解质 |
|
<, B style="mso-bidi-font-weight: normal">电离程度 |
完全 |
部分 |
|
溶液里粒子 |
水合离子 |
分子、水合离子 |
|
同条件下导电性 |
强 |
弱 |
|
物质类别 |
强碱、强酸、大多数盐 |
弱碱、弱酸、水 |
|
化合物类型 |
离子化合物、某此共价化合物 |
某些共价化合物 |
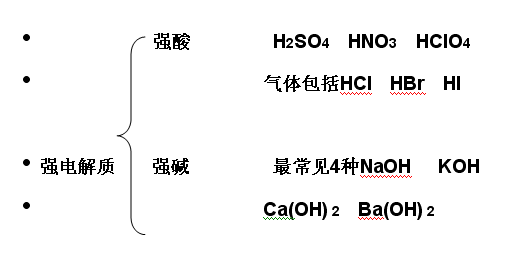
• 大多数盐大多数盐 中学见到的盐都是
[讨论]BaSO4、CaCO3、AgCl等难溶于水的盐是否属电解质?CH3COOH易溶,是否属强电解质?
[小结]BaSO4、CaCO3、AgCl虽然难溶,但溶解的极少部分却是完全电离,所以它们是强电解质,CH3COOH体易溶于水,但它却不能完全电离,所以属弱电解质。因此,电解质的强弱跟其溶解度无必然联系,本质区别在于它们在水溶液中的电离程度。
[布置作业]复习、预习
谢谢各位
专家批评指正!
